viernes, 13 de diciembre de 2013
Presentación
A petición de mi profesor de Control Alimentario, Carlos González, creo este blog, con la esperanza que poco a poco vaya conteniendo toda la información necesaria no sólo para hacerlo atractivo sino conseguir la finalidad para la que ha sido creado.
La competencia de este módulo, será controlar y supervisar la composición cualitativa de los alimentos, para ello realizaremos prácticas en Laboratorio que ampliaremos con la correspondiente teoría y viceversa.
Los contenidos irán expuestos en forma de entradas, de forma que poco a poco y a lo largo del curso se irán incorporando todos los temas.
jueves, 12 de diciembre de 2013
Seguridad en el Laboratorio Químico
En términos generales, un laboratorio puede caracterizarse por:
VARIEDAD de:
• Operaciones
• Instalaciones, equipos y utillajes
• Productos químicos de diferentes peligrosidades
• Personal (en el caso de centros de formación)
TODO ELLO implica RIESGOS MÚLTIPLES y de DIFERENTE NATURALEZA.TIPOS DE RIESGOS POSIBLES:
Asfixia.
Atrapamiento por o entre objetos.
Caída de objetos desprendidos.
Caída de objetos en manipulación.
Caída de personas a distinto nivel.
Caída de personas al mismo nivel.
Contacto térmico.
Corte.
Choque contra objetos inmóviles.
Choque contra objetos móviles.
Explosión.
Exposición a contactos eléctricos.
Exposición a radiaciones.
Exposición a ruido.
Exposición a sustancias nocivas o tóxicas.
Exposición a temperaturas ambientales extremas.
Exposición a substancias corrosivas.
Golpe por objetos o herramientas.
Incendio.
Proyección de fragmentos o partículas.
Sobreesfuerzo.
La Seguridad es responsabilidad de la línea jerárquica.
Todos los accidentes pueden ser evitados
Las personas son la base fundamental en la gestión de la
prevención de riesgos laborales.
Una gestión efi caz de la Prevención de Riesgos Laborales
produce una mejora en el sistema de calidad, así como en el
aumento de producción.
La prevención efectiva de riesgos laborales evita días perdidos
debidos a las bajas causadas por accidentes o por enfermedades
derivadas del trabajo.
PRIMEROS AUXILIOS
miércoles, 4 de diciembre de 2013
Direcciones URL
Algunas direcciones que puedan ser de utilidad
VOCABULARIO ESPECIFICO
http://www.todofp.es
UNIVERSIDAD DE VALENCIA
http://www.youtube.com/results?search_query=universidad+de+valencia+practicas+quimica&sm=12
PANREAC
http://www.panreac.es/
ELIMINACION DE RESIDUOS
http://www.mtas.es/insht/ntp/ntp_276.htm#nota2
DENSIMETROS
http://www.brand.de/images/download/prospekte/cat_spa/3%20gk600span_109-124_%20temp_densidad.pdf
DENSÍMETROS Y CONVERSIÓN GRADOS
VOCABULARIO ESPECIFICO
http://www.todofp.es
UNIVERSIDAD DE VALENCIA
http://www.youtube.com/results?search_query=universidad+de+valencia+practicas+quimica&sm=12
PANREAC
http://www.panreac.es/
ELIMINACION DE RESIDUOS
http://www.mtas.es/insht/ntp/ntp_276.htm#nota2
DENSIMETROS
http://www.brand.de/images/download/prospekte/cat_spa/3%20gk600span_109-124_%20temp_densidad.pdf
DENSÍMETROS Y CONVERSIÓN GRADOS
METODOLOGÍAS ANALÍTICAS
domingo, 1 de diciembre de 2013
Formas de expresar la concentración
DISOLUCIONES
Una disolución es una mezcla homogénea de dos o más sustancias.
Disolvente o cuerpo dispersante; componente que determina el estado de la
Soluto o cuerpo disperso; sustancia dispersada en el disolvente y que seencuentra en menor proporción.
Tamaño fase dispersa Clase de disolución
Superior a 0,1 μm Disolución grosera
Entre 0,1 y 0,001 μm Disolución coloidal
Inferior a 0,001 μm Disolución verdadera
DISOLUCIÓN = SOLUTO + DISOLVENTE
MODOS DE EXPRESAR LA CONCENTRACIÓN DE LAS DISOLUCIONES
La cantidad relativa de soluto o disolvente en una disolución se expresa mediante las
llamadas unidades de concentración. Las más importantes son:
Unidades Físicas
- Porcentajes o tantos por ciento:
- Porcentaje en peso.(p/p)
- Porcentaje en peso- volumen. (p/v)
- Porcentaje en volumen. (v/v)
- Partes por millón (p.p.m)
Unidades Químicas
- Molaridad.
- Normalidad.
- Molalidad.
En toda disolución hay que distinguir:
disolución y está en mayor proporción.
Superior a 0,1 μm Disolución grosera
Entre 0,1 y 0,001 μm Disolución coloidal
Inferior a 0,001 μm Disolución verdadera
DISOLUCIÓN = SOLUTO + DISOLVENTE
MODOS DE EXPRESAR LA CONCENTRACIÓN DE LAS DISOLUCIONES
La cantidad relativa de soluto o disolvente en una disolución se expresa mediante las
llamadas unidades de concentración. Las más importantes son:
Unidades Físicas
- Porcentajes o tantos por ciento:
- Porcentaje en peso.(p/p)
- Porcentaje en peso- volumen. (p/v)
- Porcentaje en volumen. (v/v)
- Partes por millón (p.p.m)
Unidades Químicas
- Molaridad.
- Normalidad.
- Molalidad.
miércoles, 27 de noviembre de 2013
Material de Laboratorio
El laboratorio está equipado con una gran variedad de materiales y aparatos para
poder realizar las distintas operaciones, determinaciones analíticas y técnicas.Por un lado tendremos el mobiliario:
Mesas de laboratorio adecuadas.
Sillas o taburetes cómodos.
Armarios y vitrinas para guardar el material y los reactivos.
Encimeras para disponer los aparatos.
Pilas para limpiar el material.
Equipamiento de emergencia.
CLASIFICACIÓN DEL MATERIAL DE LABORATORIO
El material se puede clasificar de varias formas:
a) Según la naturaleza o composición del material: vidrio, plástico, porcelana y metal.
b) Por su peso: material ligero y material pesado.
c) Según precise de reposición continua: material fungible ( desechable o recuperable), material inventariable.
MATERIAL FUNGIBLE
MATERIAL INVENTARIABLE
Balanzas, centrífugasBaños termostatizados, estufasDuchas de seguridad, lavaojosSillas, mesas, armarios
d) Por su función o uso: material volumétrico, material no volumetrico, material de uso específico y material de soporte.
Distintos tipos de materiales que encontraremos en un laboratorio:
martes, 19 de noviembre de 2013
Balazas
La balanza es el instrumento que cuantifica la masa (m) de una sustancia, y la masa es
una característica de cada sustancia y es invariable. Cuando una determinada masa se
somete a la fuerza de gravedad (g) de la tierra, entonces se denomina peso (p).
Las balanzas de las que disponemos en el laboratorio son las siguientes, en función de la capacidad máxima de peso.
Capacidad máx 310 g y d= 0,01g
Capacidad max 3100 g y d= 0,1g

Capacidad max. 110 g y d=0,1g
una característica de cada sustancia y es invariable. Cuando una determinada masa se
somete a la fuerza de gravedad (g) de la tierra, entonces se denomina peso (p).
Las balanzas de las que disponemos en el laboratorio son las siguientes, en función de la capacidad máxima de peso.
Capacidad máx 310 g y d= 0,01g
Capacidad max 3100 g y d= 0,1g

Capacidad max. 110 g y d=0,1g
martes, 12 de noviembre de 2013
Prácticas realizadas
Entre las prácticas que hemos realizado veremos Valoraciones-Titulaciones, Densidad y pH
Valoraciones-Titulaciones
Consiste en la determinación de la concentración
de una sustancia mediante el cálculo del volumen gastado de otra sustancia de concentración
conocida, llamada muestra valorada o patrón, que ha de reaccionar completamente
con la sustancia a analizar o muestra problema. Valoracion de NAOH En primer lugar preparamos las disoluciones de NaOH, Ácido Oxálico y Fenolftaleína al 1%.
Tenemos una disolución de un patrón primario de concentración conocida, Ácido Oxálico, al que añadimos un indicador, fenolftaleína, para comprobar la concentración de un patrón secundario, NaOH, que hemos preparado previamente.
Cebamos la bureta con NaOH al 0´1 N enrasando a 0.
Pipeteamos 10ml Ácido Oxálico 0´1N y lo vertemos a un matraz erlenmeyer.
Añadimos 3 gotas de fenolftaleína y agitamos.
Colocamos el matraz erlenmeyer bajo la bureta y abrimos la llave.
Posteriormente realizaremos los cálculos
Valoracion de LECHE
Tenemos una disolución de patrón primario de concentración ya valorada, NaOH, para comprobar la concentración de la leche, al que añadiremos un indicador, fenolftaleína.
Enrasamos la bureta con el NaOH.
Echamos leche en un vaso de precipitados, pipeteamos 9ml y lo pasamos a un matraz erlenmeyer.
Añadimos 3 gotas de fenolftaleína y agitamos.
Colocamos el matraz bajo la bureta y cuando la leche esté color rosa más de 15 seg cerramos la llave.
Medimos el volumen de NaOH gastado.
Posteriormente realizaremos los cálculos
Valoracion de VINAGRE
Tenemos una disolución de patrón primario de concentración ya valorada, NaOH 0´5N, para comprobar la concentración del vinagre, al que añadiremos un indicador, la fenolftaleína.
Enrasamos la bureta con NAOH.
Echamos vinagre en un vaso de precipitados, filtrándolo con papel para eliminar las impurezas.
Pipeteamos 10ml y lo pasamos a un matraz erlenmeye.
Añadimos agua destilada hasta 100ml y echamos 3 gotas de fenolftaleína. Agitamos.
Colocamos el matraz bajo la bureta y abrimos la llave hasta el cambio de color.
Posteriormente realizaremos los cálculos
Preparación del material:
Posición de las manos para la realización
Cuando se pone de color rosa durante 15 seg cerramos la llave y medimos el volumen de gastado.
Hay que tener precaución que no quede sobrevalorada, hay un exceso de color como se aprecia en la foto siguiente:
Cálculos
(Se realiza la práctica 3 veces y se calcula la media)
Volumen de NaOH gastado, 10´9 ml
Aplicamos la fórmula:
V1 . C1 = V2 . C2
10´9 . C1 = 10 . 0´1
C1 = 0´009N
Volumen de LECHE gastado, 10´9 ml
El volumen medio de NaOH gastado es de 2´1 ml
Aplicamos la fórmula:
V1 . C1 = V2 . C2
9 . C1 = 2´1 . 0´1
C1 = 0´023 N
Realizamos el cálculo teniendo en cuenta 100ml:
0´023/ 10ml0 x/ 100ml
x= 0´23 % por cada 100ml
Volumen de VINAGRE
El volumen medio de NaOH gastado es de 23´2 ml
Aplicamos la fórmula:
V1 . C1 = V2 . C2
10 . C1 = 23´2 . 0´5
C1 = 1´16 N
Densidad
Se llama densidad de un cuerpo (r) al cociente entre su masa y el volumen que
ocupa.
Un densímetro, es un instrumento de medición que sirve para determinar la densidad relativa de los líquidos sin necesidad de calcular antes su masa y volumen.
Normalmente, está hecho de vidrio y consiste en un cilindro hueco con un bulbo pesado en su extremo para que pueda flotar en posición vertical.
La densidad se mide en grados Baumé y grados Brix
En la práctica, el densímetro se introduce vertical y cuidadosamente en el líquido hasta que flote libre y verticalmente. A continuación, se observa en la escala graduada en el vástago del densímetro su nivel de hundimiento en el líquido; esa es la lectura de la medida de densidad relativa del líquido.
pH
El pH es unb parámetro físico-químico que mide la capacidad que tienen las sustancias de ceder o captar hidrogeniones (cationes) hidrógeno o protones H*.
Las sustancias que ceden H* se llaman ácidos y las que captan H* se llaman bases.
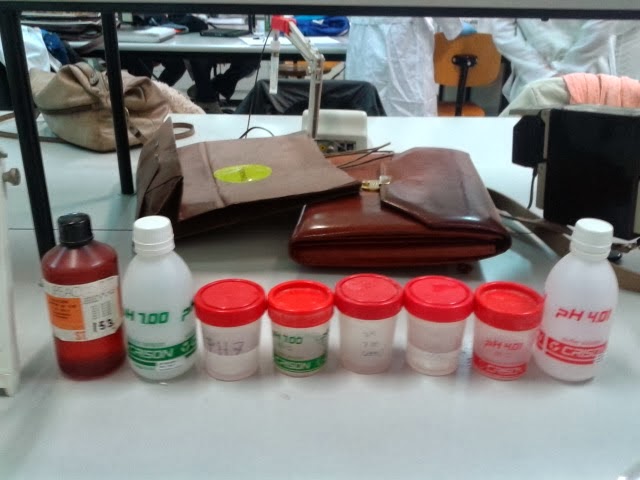
Los phmetros que tenemos en el Laboratorio son
Y las sustancias tampón para su calibración
Valoraciones-Titulaciones
Consiste en la determinación de la concentración
de una sustancia mediante el cálculo del volumen gastado de otra sustancia de concentración
conocida, llamada muestra valorada o patrón, que ha de reaccionar completamente
con la sustancia a analizar o muestra problema. Valoracion de NAOH En primer lugar preparamos las disoluciones de NaOH, Ácido Oxálico y Fenolftaleína al 1%.
Tenemos una disolución de un patrón primario de concentración conocida, Ácido Oxálico, al que añadimos un indicador, fenolftaleína, para comprobar la concentración de un patrón secundario, NaOH, que hemos preparado previamente.
Cebamos la bureta con NaOH al 0´1 N enrasando a 0.
Pipeteamos 10ml Ácido Oxálico 0´1N y lo vertemos a un matraz erlenmeyer.
Añadimos 3 gotas de fenolftaleína y agitamos.
Colocamos el matraz erlenmeyer bajo la bureta y abrimos la llave.
Posteriormente realizaremos los cálculos
Valoracion de LECHE
Tenemos una disolución de patrón primario de concentración ya valorada, NaOH, para comprobar la concentración de la leche, al que añadiremos un indicador, fenolftaleína.
Enrasamos la bureta con el NaOH.
Echamos leche en un vaso de precipitados, pipeteamos 9ml y lo pasamos a un matraz erlenmeyer.
Añadimos 3 gotas de fenolftaleína y agitamos.
Colocamos el matraz bajo la bureta y cuando la leche esté color rosa más de 15 seg cerramos la llave.
Medimos el volumen de NaOH gastado.
Posteriormente realizaremos los cálculos
Valoracion de VINAGRE
Tenemos una disolución de patrón primario de concentración ya valorada, NaOH 0´5N, para comprobar la concentración del vinagre, al que añadiremos un indicador, la fenolftaleína.
Enrasamos la bureta con NAOH.
Echamos vinagre en un vaso de precipitados, filtrándolo con papel para eliminar las impurezas.
Pipeteamos 10ml y lo pasamos a un matraz erlenmeye.
Añadimos agua destilada hasta 100ml y echamos 3 gotas de fenolftaleína. Agitamos.
Colocamos el matraz bajo la bureta y abrimos la llave hasta el cambio de color.
Posteriormente realizaremos los cálculos
Preparación del material:
Posición de las manos para la realización
Cuando se pone de color rosa durante 15 seg cerramos la llave y medimos el volumen de gastado.
Hay que tener precaución que no quede sobrevalorada, hay un exceso de color como se aprecia en la foto siguiente:
Cálculos
(Se realiza la práctica 3 veces y se calcula la media)
Volumen de NaOH gastado, 10´9 ml
Aplicamos la fórmula:
V1 . C1 = V2 . C2
10´9 . C1 = 10 . 0´1
C1 = 0´009N
Volumen de LECHE gastado, 10´9 ml
El volumen medio de NaOH gastado es de 2´1 ml
Aplicamos la fórmula:
V1 . C1 = V2 . C2
9 . C1 = 2´1 . 0´1
C1 = 0´023 N
Realizamos el cálculo teniendo en cuenta 100ml:
0´023/ 10ml0 x/ 100ml
x= 0´23 % por cada 100ml
Volumen de VINAGRE
El volumen medio de NaOH gastado es de 23´2 ml
Aplicamos la fórmula:
V1 . C1 = V2 . C2
10 . C1 = 23´2 . 0´5
C1 = 1´16 N
Densidad
Se llama densidad de un cuerpo (r) al cociente entre su masa y el volumen que
ocupa.
Un densímetro, es un instrumento de medición que sirve para determinar la densidad relativa de los líquidos sin necesidad de calcular antes su masa y volumen.
Normalmente, está hecho de vidrio y consiste en un cilindro hueco con un bulbo pesado en su extremo para que pueda flotar en posición vertical.
La densidad se mide en grados Baumé y grados Brix
En la práctica, el densímetro se introduce vertical y cuidadosamente en el líquido hasta que flote libre y verticalmente. A continuación, se observa en la escala graduada en el vástago del densímetro su nivel de hundimiento en el líquido; esa es la lectura de la medida de densidad relativa del líquido.
pH
El pH es unb parámetro físico-químico que mide la capacidad que tienen las sustancias de ceder o captar hidrogeniones (cationes) hidrógeno o protones H*.
Las sustancias que ceden H* se llaman ácidos y las que captan H* se llaman bases.
Los phmetros que tenemos en el Laboratorio son
Y las sustancias tampón para su calibración
Suscribirse a:
Comentarios (Atom)